Научно-практическая статья спикера II Международной фитнес-конвенции «Т..Р.И.У.М.Ф.» Арутюна Бабаляна
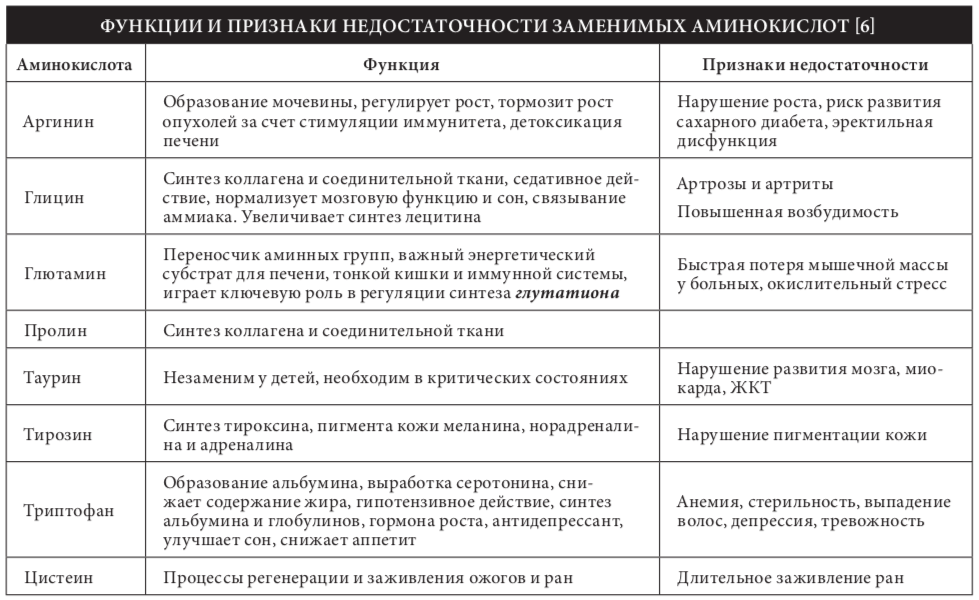
Известно около 200 природных аминокислот, из них только 20 входят в состав белков. Эти аминокис- лоты называют протеиногенными — строящими белки. В организме человека наряду с протеино- генными аминокислотами можно наи?ти и другие, которые играют иную роль, например, орнитин, ?-аланин, таурин и др.. Многие из протеиноген- ных аминокислот в организме человека выполня- ют важные самостоятельные функции, например, глицин, глютаминовая и аспарагиновая кислоты являются биологически активными соединениями, фенилаланин, тирозин и триптофан служат ис- точником образования биогенных аминов и других биорегуляторов, глицин и таурин входят в состав желчных кислот.
Стереоизомеры аминокислот. Из-за асимме- трии молекулы все ?-аминокислоты, за исключением глицина, могут существовать в форме двух D- или L-стереоизомеров — оптических изомеров, которые представляют собои? зеркальные изображения друг друга. В ходе биосинтеза белка в его состав попадают только L-аминокислоты. Следует подчеркнуть, что присутствие в составе белка L-аминокислот опре- деляет его структуру и свои?ства. D-аминокислоты никогда не включаются в белки в процессе биосин- теза. В то же время в составе белка можно обнару- жить и D-аминокислоты. Причина этого парадокса
заключается в том, что для аминокислот характерна медленная самопроизвольная неферментативная рацемизация, в резуль- тате которои? в составе белка появляются D-аминокислоты. По этои? причине структура белка со временем начинает меняться, могут изменяться и его свои?ства. Это является одним из механизмов старения белков, что вызывает необходимость их непрерывного обновления.
Онкотическое давление. Гидрофобные ами- нокислоты, как правило, располагаются внутри молекулы белка, тогда как гидрофильные — на внешнеи? поверхности, что делает гидрофильными и хорошо растворимыми в воде молекулы белка. Благодаря этому свои?ству белки хорошо связывают воду, удерживая жидкость в крови, в межклеточном пространстве и внутри клеток. Гидрофильность белков крови обеспечивают онкотическое давление, которое удерживает жидкость в кровеносных сосу- дах. При уменьшении содержания белка в организме человека в первую очередь уменьшается количество плазменных белков, что приводит к снижению он- котического давления крови, выходу жидкости из кровеноснои?системывмежклеточноепространство, чтоможетприводитьквозникновениюбезбелковых (голодных) отеков. Гидрофильность пищевых белков обеспечивает их способность набухать, образовы- вать студни, эмульсии и пены. Гидрофильность белков клеи?ковины злаков определяет качество зерна и его хлебопекарные свои?ства.
Функциональная классификация аминокислот. С физиологических позиции? аминокислоты можно разделить на:
- Протеиногенные, которые входят в состав бел-
- ка (20 аминокислот), и непротеиногенные, не входящие в состав белка, но выполняющие в организме человека другие важные функции.
- Заменимые (8 аминокислот) и незаменимые (12 аминокислот). О них мы будем говорить ниже.
- Глюкогенные, которые превращаются в глю- козу и далее в гликоген или расщепляются по пути метаболизма глюкозы с образованием АТФ. Глюкогенными, в тои? или инои? степени, являют- ся подавляющее большинство — 19 аминокислот, за исключением леи?цина.
- Кетогенные, которые могут превращаться в кетоновые тела (короткоцепочечные жирные кислоты). Кетогенными являются 6 аминокис- лот: изолеи?цин, леи?цин, лизин, тирозин, трип- тофан и фенилаланин.
При длительном голодании это приводит к массивному распаду мышечного белка и снижения содержания белка и его фракции? в сыворотке крови. Диеты с низким (недостаточным) количеством углеводов также ведут к деградации мышечных и сывороточных белков.
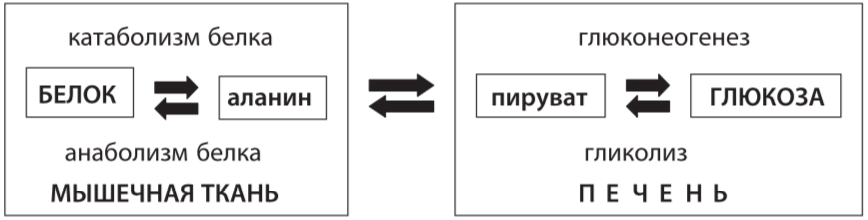
Цикл аланина, которыи? характерен для мышечнои? ткани (рис. 3). При дефиците глюкозы в организме или при голодании усиливается катабо- лизм мышечных белков с освобождением свободных аминокислот, около 50% которых составляет аланин [2]. Аланин поступает в печень, где из него образу- ется пируват, которыи? включается в глюконеогенез. Когда в мышечнои? ткани возобновляется биосинтез белка, возникает потребность в аланине, которыи? начинает синтезироваться из пирувата. В свою очередь источником пирувата является глюкоза, из которои? он образуется в результате гликолиза. Таким образом, аланин завершает свои? кругооборот.
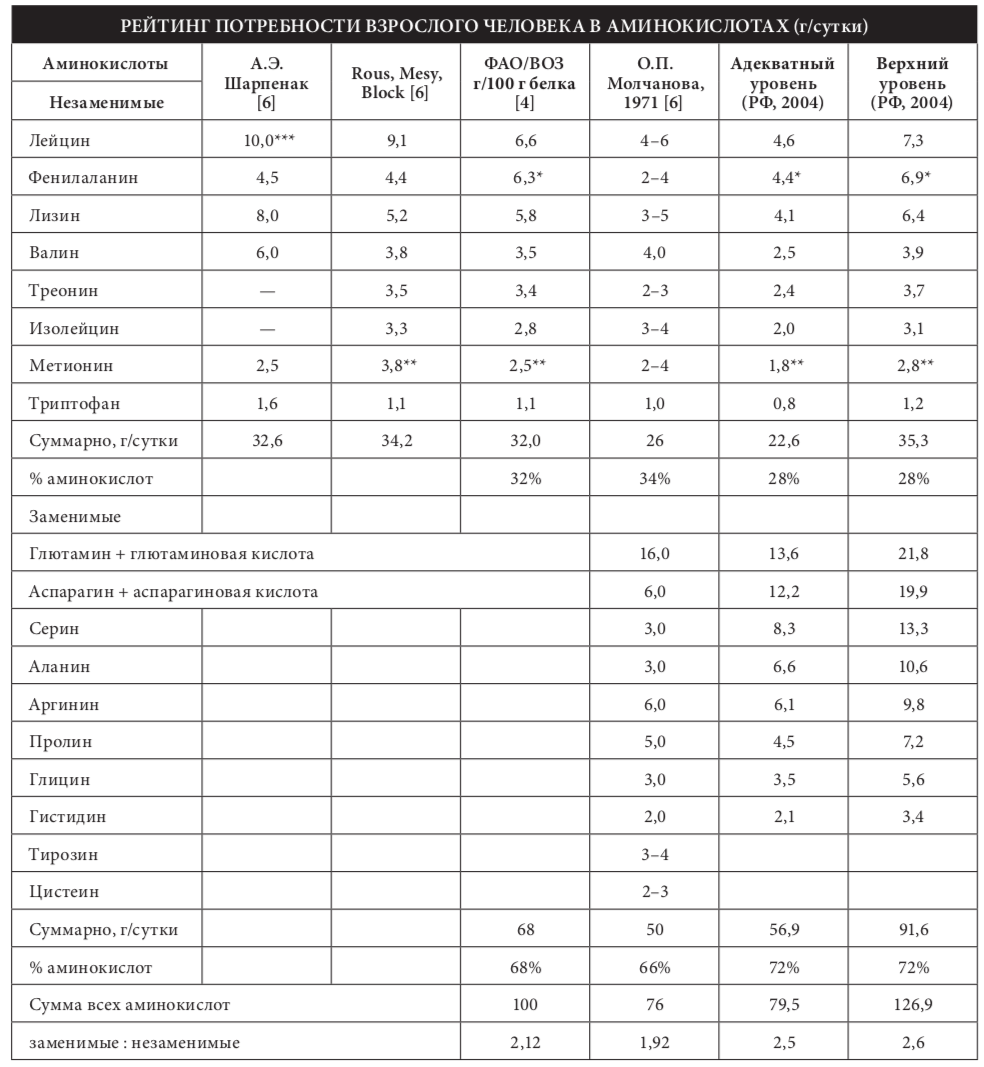
В основе разноголосицы в определении важ- ности и незаменимости тех или иных аминокислот лежат особенности их биосинтеза и метаболизма в организме человека. За исключением двух амино- кислот — лизина и треонина, которые являются у человека абсолютно незаменимыми, остальные
«незаменимые» аминокислоты в определенных ко- личествах могут синтезироваться за счет реакции? трансаминирования, но объем их синтеза является недостаточным.
Ряд незаменимых аминокислот являются пред- шественниками для синтеза заменимых. Например, из незаменимои? аминокислоты фенилаланина синтезируется заменимая аминокислота тиро- зин, а из незаменимого метионина — заменимыи? цистеин. Установлено, что до 80–89% метионина может трансформироваться в цистеин, а 70–75% фенилаланина — в тирозин [2]. По этои? причине незаменимых аминокислот метионина и фенила- ланина требуется больше, так как существенная их часть должна расходоваться на образование цистеина и тирозина. Аминокислоты цистеин и тирозин по своему физиологическому значению близки к незаменимым аминокислотам, к которым их относили ранее. Таким образом, поступление с пищеи? цистеина и тирозина позволяют сократить потребность в незаменимых аминокислотах мети- онине и фенилаланине.
С метаболических позиции? абсолютно замени- мыми являются глютаминовая кислота и серин, которые в необходимых количествах синтезируются из кетокислот. Биосинтез остальных «заменимых» аминокислот в организме человека ограничен. По этои? и другим причинам полностью обеспечить потребность организма только за счет биосинтеза большинства заменимых аминокислот невозможно.
Однако для обеспечения «надежного уровня потребления», белка требуется больше — 56,25–57,5 г белка казеина в сутки при калории?ности пищевого рациона около 3000 ккал/ сутки.
Выделяют «оптимальную потребность человека в белке», которая должна превышать надежныи? уровень на 50% и будет со- ставлять 84,4–87,5 г белка/сутки
Чем ниже биологическая ценность белка, тем больше его требуется. Однако в этом случае неко- торые аминокислоты будут поступать в организм человека в избыточном количестве, превышающем текущие потребности, связанные с биосинтезом белка и специфическим метаболизмом отдельных аминокислот.
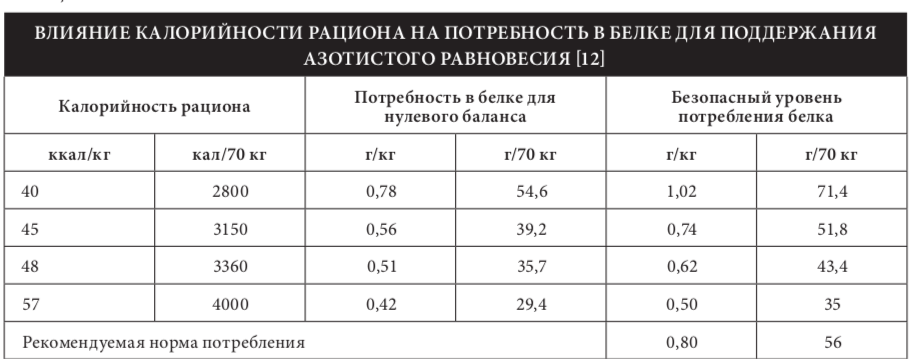
Потребность в белке во многом зависит от ка- лории?ности и состава других компонентов пищевого рациона — углеводов и липидов (табл. 14). Низкокалории?ные диеты или диеты с недостаточным количеством углеводов увеличивают потреб- ность в белке, поскольку часть белка начинает рас- ходоваться для образования глюкозы и кетоновых тел. При отсутствии в пищевом рационе углеводов и жиров для достижения азотистого равновесия пищевого белка требуется в 5 раз больше
Белок пищи необходим не только для биосинтеза белков организма, но и для решения энергетических проблем, особенно в критических ситуациях.
- Отдельные аминокислоты пищевого белка вы- полняют в организме самостоятельную функ- цию, что необходимо учитывать при назначении аминокислот, используя отдельные аминокислоты для коррекции питания.
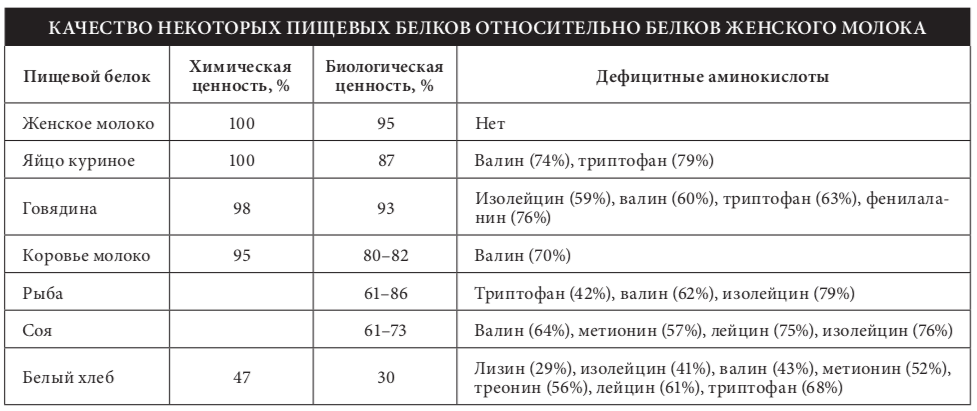
- Идеальными белками по составу и пропорциям незаменимых аминокислот являются белки молока и куриного яи?ца и в меньшеи? степени — белки мяса. Растительные белки содержат аминокислоты в иных пропорциях и дефицитны по большинству незаменимых аминокислот.
- Избыточное потребление белковои? пищи «не идет нам впрок», поскольку лишние амино- кислоты пищи будут разрушаться, а белковыи? азот удаляться из организма. Потребление белка должно быть равномерным на протяже- нии суток, что позволяет оптимизировать его всасывание и утилизацию, а также свести к минимуму потери аминокислот.
- Умеренноепотреблениебелканеявляется столь катастрофичным для организма человека, поскольку при этом снижаются потери аминокислот.
- Для достижения разных целеи? необходимы белковые модули с разным количеством и соотношением как заменимых, так и незаменимых аминокислот.